CALOR ESPECÍFICO
Se define como la catidad de calor necesaria
para elevar la temperatura de la unidad de masa de un elemento o
compuesto en un grado. En el sistema internacional sus unidades serán
por tanto J·kg-1·K-1.
El calor específico del agua es de 4180 J·kg-1·K-1.
Teniendo en cuenta esta definición de calor específico propio de un cuerpo o un sistema Ce podemos deducir que el calor absorbido o cedido por un cuerpo de masa m cuando su temperatura varía desde una temperatura T1 hasta otra T2 (ΔT = T2 - T1) vendrá dado por la expresión:
Q = m·Ce·ΔT
Cuando dos cuerpos que están a distinta
temperatura se ponen en contacto se produce un flujo de calor desde el
que está a mayor temperatura hacia el que está a menor temperatura hasta
que ambas temperaturas se igualan. Se dice que se ha alcanzado el
equilibrio térmico:
CICLO CARNOT
El ciclo de Carnot se produce cuando un equipo que trabaja absorbiendo una cantidad de calor Q1 de la fuente de alta temperatura, cede un calor Q2 a la de baja temperatura produciendo un trabajo sobre el exterior. El rendimiento viene definido por
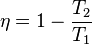
y, como se verá adelante, es mayor que cualquier máquina que funcione cíclicamente entre las mismas fuentes de temperatura. Una máquina térmica que realiza este ciclo se denomina máquina de Carnot.
Como todos los procesos que tienen lugar en el ciclo ideal son reversibles, el ciclo puede invertirse. Entonces la máquina absorbe calor de la fuente fría y cede calor a la fuente caliente, teniendo que suministrar trabajo a la máquina. Si el objetivo de esta máquina es extraer calor de la fuente fría se denomina máquina frigorífica, y si es ceder calor a la fuente caliente, bomba de calor.
CICLO RANKINE
El ciclo de Rankine es un ciclo termodinámico que tiene como objetivo la conversión de calor en trabajo, constituyendo lo que se denomina un ciclo de potencia. Como cualquier otro ciclo de potencia, su eficiencia está acotada por la eficiencia termodinámica de un ciclo de Carnot
que operase entre los mismos focos térmicos (límite máximo que impone
el Segundo Principio de la Termodinámica). Debe su nombre a su
desarrollador, el ingeniero y físico escocés William John Macquorn Rankine.
ecuaciones
EFICIENCIA TÉRMICA
En la termodinámica, la eficiencia térmica es una medida adimensional rendimiento de un dispositivo que utiliza energía térmica, tal como un motor de combustión interna, una turbina de vapor o un motor de vapor, una caldera, un horno, o un refrigerador, por ejemplo.
En general, la eficiencia de conversión de energía es la relación entre la potencia útil de un dispositivo y la entrada, en términos de energía. Para la eficiencia térmica, la entrada,, al dispositivo es el calor, o el contenido de calor de un combustible que se consume. La salida deseada es el trabajo mecánico, o el calor, o posiblemente ambos. Debido a que el calor de entrada normalmente tiene un verdadero coste económico.
LEY DE GAY-LUSSAC
Para una cierta cantidad de gas, al aumentar la temperatura, las moléculas del gas se mueven más rápidamente y por lo tanto aumenta el número de choques contra las paredes por unidad de tiempo, es decir, aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar. Gay-Lussac descubrió que, en cualquier momento del proceso, el cociente entre la presión y la temperatura absoluta tenía un valor constante.
Supongamos que tenemos un gas que se encuentra a una presión P1y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
C++




















0 comentarios:
Publicar un comentario